
该项研究首次报道软骨细胞内存在大量血红蛋白形成的血红蛋白体,它们可以储存氧气,从而为软骨细胞提供氧稳态微环境以适应各种低氧应激。这一发现打破了软骨细胞耐受缺氧只依赖HIFs通路的传统观念,具有广泛的应用价值;为理解地中海贫血患者常见的关节痛、类风湿关节炎患者常伴的贫血、高原驻训高发关节疾病以及航空或潜水减压病关节痛、大剂量地塞米松诱发股骨头坏死以及天气变化加重关节疾病症状等现象或机制等提供了全新视角。
据张丰介绍,软骨组织处于没有血管的低氧环境中,其供氧主要来自于软骨组织周围血管内氧气的弥散。由于软骨组织大多位于关键负重部位,其所承受的压力常常影响该弥散过程。因此,软骨细胞如何耐受各种低氧应激,目前并不清楚。

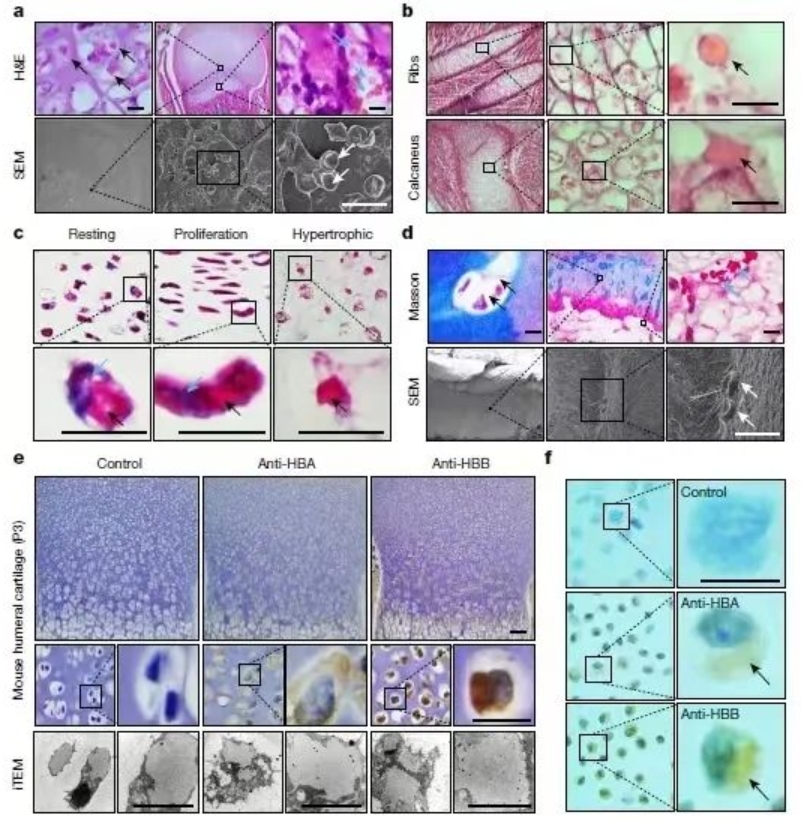
2017年,张丰在实验过程中偶然发现,小鼠股骨生长板的肥大软骨细胞内,有大小和颜色非常类似骨髓内红细胞的血红蛋白体(图a);此外还存在于软骨生长板静息区和增生区的软骨细胞内(图b,c)。同时,张丰在人的关节软骨细胞内也发现了血红蛋白体(图d)。因此,他得出结论:不受物种和解剖部位限制,血红蛋白体是软骨细胞的一个基本结构单位或新的细胞器。经免疫组化和质谱分析显示,血红蛋白体的主要成分是血红蛋白β亚基Hbb,还有少量的α亚基Hba(图e,f)。
上图显示为软骨细胞内存在血红蛋白体
a-c:小鼠软骨组织的软骨细胞内存在血红蛋白体。
d:人关节软骨细胞内存在血红蛋白体。
e,f:免疫组化检测血红蛋白体表达大量Hbb和少量Hba。
经过进一步研究分析,张丰发现,软骨细胞在缺氧环境中表达大量的血红蛋白聚集在一起形成血红蛋白体,软骨细胞内的血红蛋白表达类似骨髓造血,均存在胚胎血红蛋白向成年血红蛋白转换的过程。软骨细胞内血红蛋白表达依赖组蛋白去甲基化酶KDM5A调节的KLF1通路,而不是HIFs信号通路,说明这是一种全新的细胞耐受缺氧机制。基因敲除小鼠实验和体外软骨培养低氧耐受实验表明,血红蛋白体缺失导致软骨不能耐受缺氧而坏死,证明了血红蛋白体对软骨细胞耐受缺氧至关重要。由于除软骨组织外,很多组织都表达血红蛋白,因此,这一发现为学界开展其他组织内血红蛋白作用的研究,提供了先例。
背景
2017年,张丰副教授科研过程中偶然发现软骨细胞内血红蛋白体,随后进一步明确其蛋白成分。通过体内外实验证明了该软骨细胞内血红蛋白体耐受缺氧的生理功能,同时发现软骨细胞内血红蛋白表达受低氧调节,依赖KLF1而不是HIFs信号通路,从而证明这是一种全新的细胞耐受缺氧机制。
2020年,张丰到北京代职,开始与孙强合作,继续深入开展血红蛋白体的液相分离性质以及氧离曲线特征等研究。孙强和其学生张波进一步明确了软骨细胞内血红蛋白体的液相分离特性,分析了软骨细胞的氧离曲线特征,进一步提升和完善了该项科研工作。